骨缺損是臨床常見的病癥,感染、腫瘤、創傷、骨髓炎手術清創,以及各種先天性疾病是導致骨缺損的主要原因。為避免影響骨骼穩定性及防止病理性骨折,需要對骨缺損進行修復,臨床上修復骨缺損的方法有骨移植、人工骨、骨組織工程等。
自體骨是傳統的也是目前最有效的骨移植材料,與其他骨移植材料相比,自體骨具有生物相容性好,成骨能力強,骨誘導活性高等優點,是目前臨床最常用的治療骨缺損的材料。但自體骨也存在一定的缺點:額外增加手術創傷和手術時間,可供骨源有限,移植骨的形態、大小等方面不易滿足要求,取骨區常出現感染、疼痛等并發癥。因此,選擇合適的骨替代物成為必然。
相較于自體骨移植,異體骨移植具有使用方便,來源相對豐富,骨細胞經處理后已被滅活,免疫原性低,可以提供結構支持等諸多優點。臨床上多采用凍干、輻照或化學處理降低免疫原性,少見明顯的排斥反應。但異體骨存在可能引起血源性疾病傳播及引起免疫反應干擾骨愈合等缺點;另外同種異體骨僅有骨傳導作用而無骨誘導作用,移植術后骨折愈合可能相對較慢。
研究各類人工植骨替代材料,以克服自體或異體骨固有的缺點,是臨床迫切需要解決的問題。理想植骨材料應該具有以下特點:良好的生物相容性;生物可吸收性;骨傳導性;骨誘導性;結構與骨相似并且性價比高;易于操作等。臨床現在常用的人工骨材料由各類骨水泥、生物陶瓷、組織化人工骨等。
其中,作為目前臨床常用的一類人工骨材料——硫酸鈣被用于骨缺損處的填充和修復已有100多年的歷史。硫酸鈣的生物細胞相容性和用作骨組織工程支架材料的可行性已被大量的動物實驗和臨床研究所證實。普通硫酸鈣制備的植入材料有較大的缺陷,如材料的無菌性、熱穩定性、吸收速度等都難以控制。美國Wright醫療器械技術公司與美國石膏公司合作,通過控制半水硫酸鈣晶體的形態和大小,進而控制硫酸鈣的降解速率,成功的研制出一種用于骨缺損修復的新型醫用硫酸鈣。目前,硫酸鈣具有骨傳導作用、促進血管和成骨細胞的長入已得到普遍認可。硫酸鈣可能具有骨細胞誘導作用,其誘導機制與硫酸鈣溶解過程中導致局部微環境pH值下降有關。
1892年, Dreesman 首次將硫酸鈣骨支架材料應用于臨床醫學填充骨組織缺損。1961年 Peltier 報道用硫酸鈣骨支架材料填充骨缺損并成功的治療了20例骨囊腫和骨髓炎患者,表明硫酸鈣骨支架材料不僅具有優良的組織細胞相容性,而且不會對有感染的骨組織缺損產生不利影響。1995年,美國Wright醫療器械公司通過控制α-半水硫酸鈣化合物晶粒的大小和形狀,成功研制了醫用外科級硫酸鈣骨支架材料Osteoset,該產品為晶體大小和形狀一致性的醫用外科級α-半水硫酸鈣,具有可控制的降解率,降解周期與骨組織的生長相一致的特點。該產品Osteoset已于1996年6月得到美國食品藥物監督管理局(FDA)的批準,同年獲得了歐洲CE標志。此后,這種材料已被上萬的臨床病例所驗證,結果表明硫酸鈣骨支架材料是安全和有效的骨組織工程支架材料。隨后,英國和德國也相繼成功研制出商業化的硫酸鈣骨支架材料Encore、Stimulan和Surgiplaster。在此基礎上,美國Wright醫療器械公司又成功研制出了用于微創的可注射性的硫酸鈣骨支架材料,該材料與Osteoset原料一樣,其不同之處是可注射性的硫酸鈣可以在手術過程中將α-半水硫酸鈣粉末與相應的固化液調和成糊狀,注射入骨缺損區域,大約5分鐘后開始固化,更便于臨床的操作。
作為最早使用的骨組織修復材料,硫酸鈣材料具有以下應用優勢:
㈠.生物細胞相容性。按照ASTM的相關規定,對醫用外科級硫酸鈣的細胞毒性、系統毒性、遺傳毒性、植入試驗、敏感性和皮內反應等,結果表明各項指標均滿足醫用外科級要求。進行的動物植入實驗和臨床治療效果也表明:醫用外科級硫酸鈣對正常的生命代謝過程不產生影響,具有優良的生物細胞相容性。
㈡.生物可降解吸收性。由于普通硫酸鈣純度低、晶體形貌和晶體結構不均勻,使得普通硫酸鈣降解吸收速度不一致,不適合作為生物材料。醫用外科級硫酸鈣的晶體為特定尺寸、形狀及結構,因此它具有比較恒定的降解吸收速度,可作為骨缺損修復材料。
㈢.骨組織傳導性。以往的動物模型實驗表明,將硫酸鈣作為骨組織缺損的填充修復材料,可被生物體降解并吸收掉,而且骨組織缺損的邊緣部分能夠再生出新的骨組織,且也能夠修復其與軟組織之間的間隙。大量的研究表明,硫酸鈣可加速骨細胞鈣化和骨組織的形成。
㈣.機械性能好。醫用外科級硫酸鈣具有穩定的三維結構,使得新的骨組織能夠按照此結構進行生長,并盡可能地使新生骨組織與正常骨組織的質地、強度和外形相似。
此外,研究也表明醫用外科級硫酸鈣屬于骨傳導性材料,植入生物體內后,能重塑骨組織的外形輪廓,阻礙軟組織的長入,它為成骨細胞和血管的長入提供了細胞外基質。
基于以上內容,作為骨缺損修復用材料,硫酸鈣具有優異的臨床應用優勢以及龐大的市場前景。
本研究團隊在多年研究的基礎上,已開發出多種硫酸鈣基骨缺損修復產品,其性能經過動物實驗驗證,性能優于同類國內外產品。
作為骨缺損修復用硫酸鈣最早及最成熟的生產廠家——美國WRIGHT公司生產的硫酸鈣人工骨OsteosetTM 于1995年通過了ISO10993、USP、ASIM的生物相容性標準檢測;并于1996年6月通過了美國FDA和歐洲CE標準認證,準其可作為長期外科植入物在臨床上使用。目前國內骨修復用硫酸鈣基本是采用美國WRIGHT公司的產品。
針對美國WRIGHT公司的硫酸鈣產品,本課題組自制硫酸鈣產品進行了以下性能對比及相關動物實驗:
1. 微觀形貌對比


圖1 自制硫酸鈣(上)與WRIGHT硫酸鈣(下)微觀形貌
圖1所示為課題組自制硫酸鈣與美國WRIGHT公司的硫酸鈣產品的微觀形貌對比圖。由圖可以看出,自制硫酸鈣與WRIGHT商品硫酸鈣結構類似,均呈短棒狀結構,且自制硫酸鈣晶粒略大于WRIGHT商品硫酸鈣。


圖2自制硫酸鈣(上)與WRIGHT硫酸鈣(下)宏觀形貌
圖2 所示為自制硫酸鈣與WRIGHT商品硫酸鈣的宏觀形貌圖,由圖可知,二者結構類似,均由硫酸鈣晶粒緊密排列構成,且課題組自制硫酸鈣通過造孔方法可以制備出與WRIGHT商品硫酸鈣類似的孔徑約10μm的微孔結構。
2. 成分對比
圖3所示為自制硫酸鈣與WRIGHT商品硫酸鈣的能譜分析結果。由圖可知,自制硫酸鈣與WRIGHT商品硫酸鈣的主要成分均由O、S、Ca構成,且其原子比例符合CaSO4的原子比。兩種材料均測定了金屬Al含量,由結果也可以看出自制硫酸鈣中Al的質量分數為0.67%,WRIGHT商品硫酸鈣中Al的質量分數為0.83%,二者均符合生物醫用植入材料相關要求。
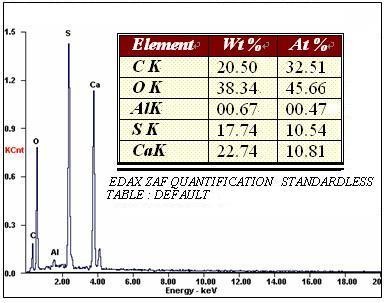
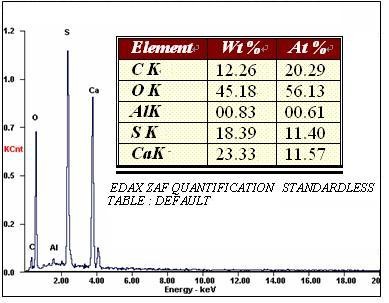
圖3自制硫酸鈣(上)與WRIGHT硫酸鈣(下)能譜分析結果
圖4所示的X-射線衍射分析結果同樣能夠表明,自制硫酸鈣與WRIGHT商品硫酸鈣的成分類似,相結構類似,均由CaSO4組成。

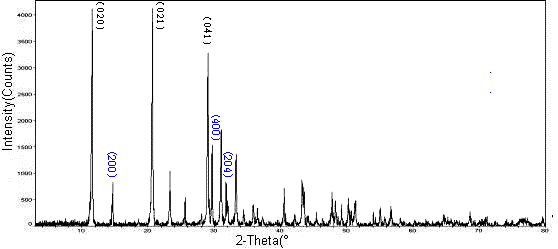
圖4自制硫酸鈣(上)與WRIGHT硫酸鈣(下)XRD分析結果
3. 降解性能分析
由于硫酸鈣自身特性,其在生物體內降解較快,臨床應用表明WRIGHT商品硫酸鈣在人體內約在4-6周內會完全降解,針對臨床應用要求,此降解速率稍過迅速。通過進行體外降解實驗,如圖5所示的結果表明,在體外環境,WRIGHT商品硫酸鈣約在40天左右完全降解,而自制硫酸其完全降解周期能延長到49天。這與我們制備過程中調控硫酸鈣的晶粒結構有關。較慢的降解速率,也使自制硫酸鈣具有更大的臨床應用優勢。

圖5自制硫酸鈣與WRIGHT硫酸鈣體外降解實驗結果
4. 動物實驗結果
圖6-9為進行的自制硫酸鈣與空白對照組兔子股骨植入實驗結果。
圖6所示為實驗進行圖以及植入當天X射線檢查結果圖。由圖可以看到實驗樣品植入部位以及空白對照動物斷骨模型。
圖7所示為自制硫酸鈣組與空白對照組植入4周X射線檢查結果圖。由圖可以看出,植入組硫酸鈣材料完全降解,骨缺損區連續骨痂形成,骨痂密度影稍低于正常,髓腔未通。而空白對照組骨缺損端有少許骨膜反應,斷端部位整齊,兩端骨髓腔均未封閉。
圖8所示為自制硫酸鈣組與空白對照組植入8周X射線檢查結果圖。由圖可知,植入硫酸鈣材料組骨缺損區形成連續性皮質骨,髓腔再通,已修復皮質骨密度影接近于正常皮質骨。空白對照組骨缺損斷端銳利、整齊,骨膜反應消失,兩端髓腔封閉,骨缺損未見愈合。
圖9所示為實驗進行8周后植入股骨部位取出光學觀察圖。由圖可以看出,硫酸鈣材料植入組骨缺損遠、近端連續性骨組織相連,兩端骨膜反應形成骨性突起,骨痂處于塑形階段。空白對照組兩端骨髓腔由纖維組織完全封閉,骨缺損未見愈合。
由動物實驗可以得出結論,本課題組自制硫酸鈣具有優異的骨缺損修復能力。



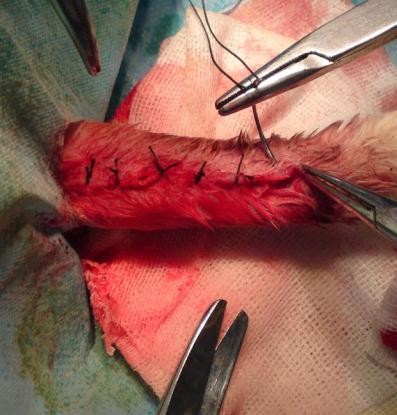

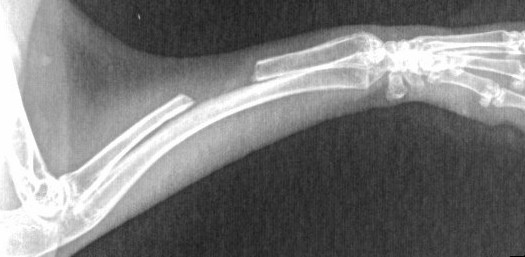
圖6 實驗進行圖以及植入當天X射線檢查結果圖
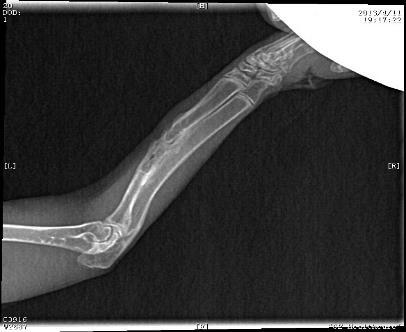


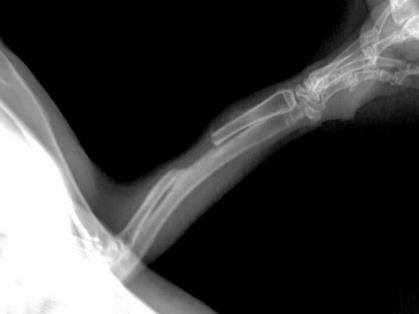
圖7自制硫酸鈣植入組(上)與空白對照組(下)植入4周X射線檢查結果
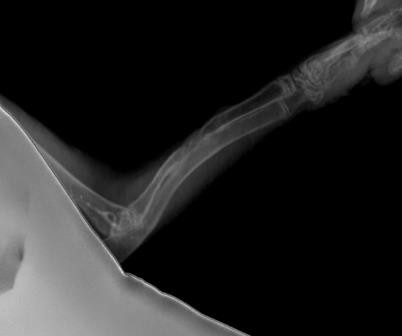



圖8自制硫酸鈣植入組(上)與空白對照組(下)植入8周X射線檢查結果

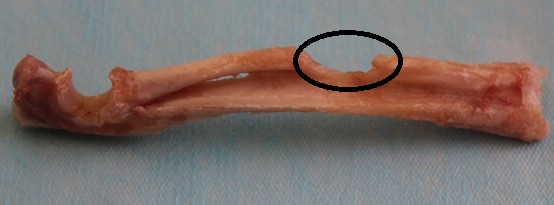
圖9自制硫酸鈣植入組(上)與空白對照組(下)植入8周植入部位取出光學圖,圈出位置為原骨缺損部位
針對本技術,目前課題組已獲批如下國家發明專利:
(1)硫酸鈣球形顆粒牙槽骨修復材料及其制備方法與應用,國家發明專利,專利號:ZL 201210528605.9
(2)一種骨組織工程用多孔復合支架及其制備方法,國家發明專利,專利號:ZL 201510708588.0
材料科學,生物醫用 500萬以上
化學化工
材料科學 面議
材料科學,化學化工 面議
材料科學 面議